
闻晓光:缓释药物越洋成功,全球进程启航
踔厉奋发,笃行不怠。近段时间,专注于应用自主创新和通用缓控释技术开发针对美国市场的NDA(505(b)(2)申报路径)和中国市场的新药(化药2类)的特色平台技术企业越洋医药连续迎来两大重磅里程碑事件。
一是,越洋医药研发的左乙拉西坦缓释片在2020年6月获得FDA批准在美国上市后,于2021年12月向销售商首次发货,这标志着其已开始从研发药企向商业化制药企业转型。二是,越洋医药完成C轮融资,投资方分别为上海医药集团、华美国际投资集团和乾道集团。越洋医药和上药将在新药产品的商业化上进行合作,募集到的资金将用于推进新药OPL-015在美国等地区16家医院500个患者的国际多中心Ⅲ期临床研究和注册申报。

越洋医药创始人、董事长兼CEO 闻晓光
505(b)(2)/二类新药是重要创新路径
越洋医药创始人、董事长兼CEO闻晓光回国的初心就是开发用505(b)(2)路径申报的NDA(新药),他在GSK和辉瑞工作期间主要从事的就是把普通制剂新药转化成缓控释制剂新药。他回国时就相信,中国本土企业率先取得在美国获批新药的突破大概率是来源于505(b)(2)路径申报的NDA,事实也证明的确是这个结果。
目前,中国本土企业有2款药物在美国获批NDA,都是通过505(b)(2)路径申报获批的,一个来源于石药,另一个来自于山东绿叶。相比于动辄就要投入10多亿、20多亿美元,历经10多年、20多年进行一类新药研发而言,由于二类新药是在原研药同一有效成分基础上开发出的迭代产品,有效成分安全性、有效性已经经过验证,相当于站在巨人肩膀上进行有效成分的二次开发,因此具有投入相对少、开发周期相对短、成功率相对高的优势。在闻晓光看来,这是一条国内本土企业能够负担得起的创新之路,更具有可行性以及现实意义。
二类新药在国内外都有很多成功的案例,例如硝苯地平从普通制剂变成缓控释新药之后,在国内的年销售额达48.9亿元;芬必得作为布洛芬普通制剂的迭代产品在国内也深受患者欢迎;琥珀酸美托洛尔缓释片作为琥珀酸美托洛尔的迭代产品,在国内的年销售额达23.4亿元;国外的舒利迭(Advair Diskus)(沙美物罗和氟替卡松的复方制剂)年销售额是45亿美元;紫杉醇白蛋白纳米粒年销售额为10亿美元;盐酸羟考酮缓释片年销售额是24亿美元;右哌甲酯缓释胶囊年销售额是13亿美元。
二类新药已成为中国本土药企新药进军国际市场的领头兵,是在新药研发水平上缩短中国与国外差距的新渠道。不过,二类新药的开发也需要付出巨大努力。例如,越洋医药的一个新药经过了17次人体药动学研究才获得了期待的结果,进而进入Ⅲ期500个人的国际临床多中心研究。
尽管二类新药的研发投入远少于一类新药的投入,但仍远高于仿制药的开发费用。对于已有的药物改良,往往有2种途径,其一是在有效成分化学结构的母核上进行结构改良,形成新的化合物。例如,在降压药有效成分硝苯地平化学结构的母核上进行结构改良,形成了新的降压药有效成分,尼莫地平、非洛地平、氨氯地平,就是在同一个化学母核结构上做的改良。其二是在保持原研药物有效成分结构不变的前提下,改变有效成分的释放行为、给药路径等对原研药物有效成分的制剂改良而产生的新药。比如,针对硝苯地平这一有效成分应用缓控释技术开发了硝苯地平缓控释新药,可以让体内血药浓度更加平稳,血压得到更有效的控制,因此受到医生和患者的欢迎,是目前降压药的主力军。
据闻晓光介绍,“这两种改良都产生了满足临床需求的新药产品,只是在申报时有区别,在美国基于新的有效成分产生的新药一般走NDA 505(b)(1)新药申报路径,在中国一般称为一类新药;基于有效成分释放行为改变的新药一般走NDA 505(b)(2)新药申报路径,在中国一般称为二类新药。因此,在相当多的情况下一类新药、二类新药本质上都是针对已有药物的改良。因此不管是一类新药还是二类新药,只要能满足未满足的临床用药需求,解决临床用药痛点,都会受到医生和患者的欢迎。”
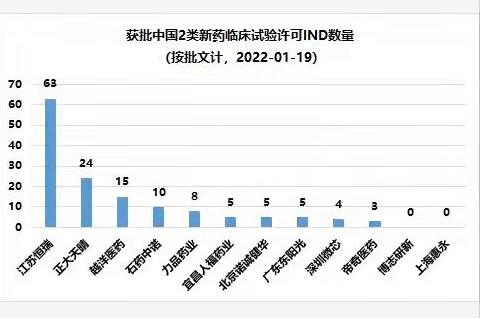
二类新药IND数量前3,缓控释新药IND数量居首
随着一类新药开发越来越困难、仿制药竞争激烈,二类新药被认为符合我国医药企业转型升级的方向,吸引了更多企业切入。截至目前,获批二类新药临床试验许可(IND)数量遥遥领先的企业是恒瑞(63个),正大天晴(24个)和越洋医药(15个)紧随其后。在缓控释新药细分领域,越洋医药口服缓控释新药获批临床试验许可(IND)数量遥遥领先(15个),恒瑞(3个)排名第二。闻晓光表示:“越洋医药在缓控释新药细分领域深耕细作十载春秋,有丰富的产品研发经验,获批临床试验许可只能算是赢在了起跑线,在国内外获批新药上市许可并且产生销售才是产品开发的终点线,我想这也是所有回国创业海归的共同心愿,越洋医药愿意和其他公司一道将其变成现实。”
据了解,越洋医药是一家以特色平台技术为核心、以满足临床未满足的需求为驱动力的国际化二类新药研发公司,其自主创新的缓控释平台技术已获得18项国内外发明专利授权(包括中国、美国、日本和欧盟)。
在闻晓光看来,利用缓控释平台技术开发新药国外已有成功案例,比如Alza公司研发的一个缓控释平台技术(渗透泵技术),在专利过期前为跨国公司研发了十多个新药产品,最终公司以109亿美元的价格被国际药企巨头收购。Horizon是另外一个利用平台技术专门从事505(b)(2)路径申报新药的公司,目前已有多个产品在市场销售,公司市值已达200多亿美元。“越洋医药属于国内很早布局二类新药开发的企业,通过10年的厚积薄发,技术逐渐成熟,多项平台专利技术的效果已在临床试验上获得了验证,获批NMPA和FDA新药临床试验许可的多款缓控释新药从今年开始都要进入Ⅱ期~Ⅲ期临床试验,还将进行新一轮更大规模的融资。”
“冠军心态”铸就行业领先地位
闻晓光身披多重光环和荣誉,包括北京大学医学部优秀校友、化学制药工业协会二类新药专委会主任委员、中国药学会制剂专业委员会和工业药剂学专委会的委员等,他也一直强调公司的人才要有“冠军心态”,在各自的岗位、专业和领域争做第一。
自成立以来,越洋医药获得过全国黑马大赛生物医药行业冠军,在 “创客中国”全国总决赛12强中是唯一一家入围的生物医药企业,目前也是国内获批固体口服缓控释药品临床试验许可最多的公司,这些成绩都源自公司自下而上的“冠军心态”。越洋医药的目标是让产品上市为人类健康提供更好的解决方案,愿景是成为国际领先的应用平台技术开发新药的公司。因此闻晓光希望越洋医药在缓控释新药细分领域始终保持领先地位。
除了在专业领域以外,闻晓光在兴趣爱好方面也竭尽全力,曾在国内外获得过多次冠军,包括在国内与国外的大学乒乓球比赛中取得冠军,国外的市、州乒乓球比赛中也得过冠军。
随着粤港澳大湾区国家战略的实施、《粤港澳大湾区药品医疗器械监管创新发展工作方案》的发布,生物医药产业迎来加快发展的战略机遇期。作为粤港澳大湾区企业代表,闻晓光非常看好大湾区在缓控释新药领域的发展前景,他指出:“粤港澳大湾区是国内缓控释新药研发的高地,越洋医药除了拥有15个中国审评中心批准的新药临床试验许可以外,还拥有12个美国FDA批准的新药临床试验许可。另外,大湾区还有多个药企积极布局缓控释新药,包括东阳光有1个IND、信立泰有1个IND、帝奇有1个IND。粤港澳大湾区是国内缓控释新药开发企业数量最多的地区,也是拥有缓控释新药临床试验许可数量最多的地区。建议粤港澳大湾区出台政策,鼓励和奖励缓控释新药的研发和全球上市,让高地成为中国的最高峰。”
2021年是“十四五”开局之年,医药行业迈向高质量发展新征程,越洋医药也已走过10年的奋斗岁月。闻晓光表示:“总结过去10年,我们赶上了二类新药发展的浪潮,国家正式出台了新的二类新药的相关法规,中国加大了生物医药市场的投资。无论是海外回流,还是本土培养,中国正集聚越来越多的医药研发人才。国家鼓励企业走出去,越洋医药积极响应号召,我们的愿景是成为国际领先的缓控释新药开发公司,将继续开发自主知识产权的缓控释平台技术,继续开展更多新药的多国申报,加快全球布局。我们的策略是‘轻资产,重技术,上下游合作,国内外合作’,像小米和苹果一样,委托代工企业进行生产;也愿意与对二类新药感兴趣的公司合作进行产品开发,风险共担,利益共享。越洋医药渴求更多人才加盟,跨海越洋携手圆梦。未来希望我们有更多新药产品走向国际,为人类健康提供解决方案,推动构建更好的人类命运共同体。”
一是,越洋医药研发的左乙拉西坦缓释片在2020年6月获得FDA批准在美国上市后,于2021年12月向销售商首次发货,这标志着其已开始从研发药企向商业化制药企业转型。二是,越洋医药完成C轮融资,投资方分别为上海医药集团、华美国际投资集团和乾道集团。越洋医药和上药将在新药产品的商业化上进行合作,募集到的资金将用于推进新药OPL-015在美国等地区16家医院500个患者的国际多中心Ⅲ期临床研究和注册申报。

越洋医药创始人、董事长兼CEO 闻晓光
505(b)(2)/二类新药是重要创新路径
越洋医药创始人、董事长兼CEO闻晓光回国的初心就是开发用505(b)(2)路径申报的NDA(新药),他在GSK和辉瑞工作期间主要从事的就是把普通制剂新药转化成缓控释制剂新药。他回国时就相信,中国本土企业率先取得在美国获批新药的突破大概率是来源于505(b)(2)路径申报的NDA,事实也证明的确是这个结果。
目前,中国本土企业有2款药物在美国获批NDA,都是通过505(b)(2)路径申报获批的,一个来源于石药,另一个来自于山东绿叶。相比于动辄就要投入10多亿、20多亿美元,历经10多年、20多年进行一类新药研发而言,由于二类新药是在原研药同一有效成分基础上开发出的迭代产品,有效成分安全性、有效性已经经过验证,相当于站在巨人肩膀上进行有效成分的二次开发,因此具有投入相对少、开发周期相对短、成功率相对高的优势。在闻晓光看来,这是一条国内本土企业能够负担得起的创新之路,更具有可行性以及现实意义。
二类新药在国内外都有很多成功的案例,例如硝苯地平从普通制剂变成缓控释新药之后,在国内的年销售额达48.9亿元;芬必得作为布洛芬普通制剂的迭代产品在国内也深受患者欢迎;琥珀酸美托洛尔缓释片作为琥珀酸美托洛尔的迭代产品,在国内的年销售额达23.4亿元;国外的舒利迭(Advair Diskus)(沙美物罗和氟替卡松的复方制剂)年销售额是45亿美元;紫杉醇白蛋白纳米粒年销售额为10亿美元;盐酸羟考酮缓释片年销售额是24亿美元;右哌甲酯缓释胶囊年销售额是13亿美元。
二类新药已成为中国本土药企新药进军国际市场的领头兵,是在新药研发水平上缩短中国与国外差距的新渠道。不过,二类新药的开发也需要付出巨大努力。例如,越洋医药的一个新药经过了17次人体药动学研究才获得了期待的结果,进而进入Ⅲ期500个人的国际临床多中心研究。
尽管二类新药的研发投入远少于一类新药的投入,但仍远高于仿制药的开发费用。对于已有的药物改良,往往有2种途径,其一是在有效成分化学结构的母核上进行结构改良,形成新的化合物。例如,在降压药有效成分硝苯地平化学结构的母核上进行结构改良,形成了新的降压药有效成分,尼莫地平、非洛地平、氨氯地平,就是在同一个化学母核结构上做的改良。其二是在保持原研药物有效成分结构不变的前提下,改变有效成分的释放行为、给药路径等对原研药物有效成分的制剂改良而产生的新药。比如,针对硝苯地平这一有效成分应用缓控释技术开发了硝苯地平缓控释新药,可以让体内血药浓度更加平稳,血压得到更有效的控制,因此受到医生和患者的欢迎,是目前降压药的主力军。
据闻晓光介绍,“这两种改良都产生了满足临床需求的新药产品,只是在申报时有区别,在美国基于新的有效成分产生的新药一般走NDA 505(b)(1)新药申报路径,在中国一般称为一类新药;基于有效成分释放行为改变的新药一般走NDA 505(b)(2)新药申报路径,在中国一般称为二类新药。因此,在相当多的情况下一类新药、二类新药本质上都是针对已有药物的改良。因此不管是一类新药还是二类新药,只要能满足未满足的临床用药需求,解决临床用药痛点,都会受到医生和患者的欢迎。”
二类新药IND数量前3,缓控释新药IND数量居首
随着一类新药开发越来越困难、仿制药竞争激烈,二类新药被认为符合我国医药企业转型升级的方向,吸引了更多企业切入。截至目前,获批二类新药临床试验许可(IND)数量遥遥领先的企业是恒瑞(63个),正大天晴(24个)和越洋医药(15个)紧随其后。在缓控释新药细分领域,越洋医药口服缓控释新药获批临床试验许可(IND)数量遥遥领先(15个),恒瑞(3个)排名第二。闻晓光表示:“越洋医药在缓控释新药细分领域深耕细作十载春秋,有丰富的产品研发经验,获批临床试验许可只能算是赢在了起跑线,在国内外获批新药上市许可并且产生销售才是产品开发的终点线,我想这也是所有回国创业海归的共同心愿,越洋医药愿意和其他公司一道将其变成现实。”
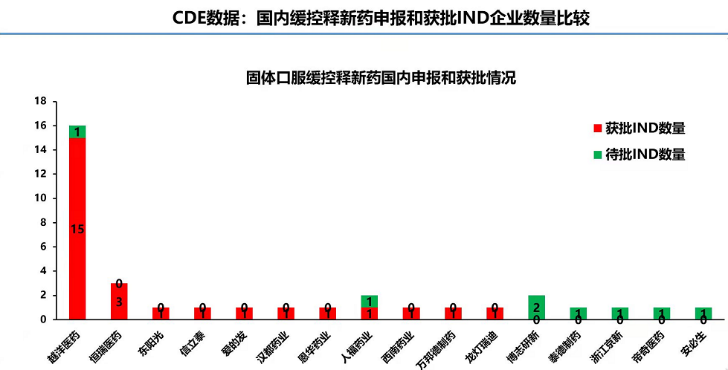
据了解,越洋医药是一家以特色平台技术为核心、以满足临床未满足的需求为驱动力的国际化二类新药研发公司,其自主创新的缓控释平台技术已获得18项国内外发明专利授权(包括中国、美国、日本和欧盟)。
在闻晓光看来,利用缓控释平台技术开发新药国外已有成功案例,比如Alza公司研发的一个缓控释平台技术(渗透泵技术),在专利过期前为跨国公司研发了十多个新药产品,最终公司以109亿美元的价格被国际药企巨头收购。Horizon是另外一个利用平台技术专门从事505(b)(2)路径申报新药的公司,目前已有多个产品在市场销售,公司市值已达200多亿美元。“越洋医药属于国内很早布局二类新药开发的企业,通过10年的厚积薄发,技术逐渐成熟,多项平台专利技术的效果已在临床试验上获得了验证,获批NMPA和FDA新药临床试验许可的多款缓控释新药从今年开始都要进入Ⅱ期~Ⅲ期临床试验,还将进行新一轮更大规模的融资。”
“冠军心态”铸就行业领先地位
闻晓光身披多重光环和荣誉,包括北京大学医学部优秀校友、化学制药工业协会二类新药专委会主任委员、中国药学会制剂专业委员会和工业药剂学专委会的委员等,他也一直强调公司的人才要有“冠军心态”,在各自的岗位、专业和领域争做第一。
自成立以来,越洋医药获得过全国黑马大赛生物医药行业冠军,在 “创客中国”全国总决赛12强中是唯一一家入围的生物医药企业,目前也是国内获批固体口服缓控释药品临床试验许可最多的公司,这些成绩都源自公司自下而上的“冠军心态”。越洋医药的目标是让产品上市为人类健康提供更好的解决方案,愿景是成为国际领先的应用平台技术开发新药的公司。因此闻晓光希望越洋医药在缓控释新药细分领域始终保持领先地位。
除了在专业领域以外,闻晓光在兴趣爱好方面也竭尽全力,曾在国内外获得过多次冠军,包括在国内与国外的大学乒乓球比赛中取得冠军,国外的市、州乒乓球比赛中也得过冠军。
随着粤港澳大湾区国家战略的实施、《粤港澳大湾区药品医疗器械监管创新发展工作方案》的发布,生物医药产业迎来加快发展的战略机遇期。作为粤港澳大湾区企业代表,闻晓光非常看好大湾区在缓控释新药领域的发展前景,他指出:“粤港澳大湾区是国内缓控释新药研发的高地,越洋医药除了拥有15个中国审评中心批准的新药临床试验许可以外,还拥有12个美国FDA批准的新药临床试验许可。另外,大湾区还有多个药企积极布局缓控释新药,包括东阳光有1个IND、信立泰有1个IND、帝奇有1个IND。粤港澳大湾区是国内缓控释新药开发企业数量最多的地区,也是拥有缓控释新药临床试验许可数量最多的地区。建议粤港澳大湾区出台政策,鼓励和奖励缓控释新药的研发和全球上市,让高地成为中国的最高峰。”
2021年是“十四五”开局之年,医药行业迈向高质量发展新征程,越洋医药也已走过10年的奋斗岁月。闻晓光表示:“总结过去10年,我们赶上了二类新药发展的浪潮,国家正式出台了新的二类新药的相关法规,中国加大了生物医药市场的投资。无论是海外回流,还是本土培养,中国正集聚越来越多的医药研发人才。国家鼓励企业走出去,越洋医药积极响应号召,我们的愿景是成为国际领先的缓控释新药开发公司,将继续开发自主知识产权的缓控释平台技术,继续开展更多新药的多国申报,加快全球布局。我们的策略是‘轻资产,重技术,上下游合作,国内外合作’,像小米和苹果一样,委托代工企业进行生产;也愿意与对二类新药感兴趣的公司合作进行产品开发,风险共担,利益共享。越洋医药渴求更多人才加盟,跨海越洋携手圆梦。未来希望我们有更多新药产品走向国际,为人类健康提供解决方案,推动构建更好的人类命运共同体。”




